
산성 및 염기성
산
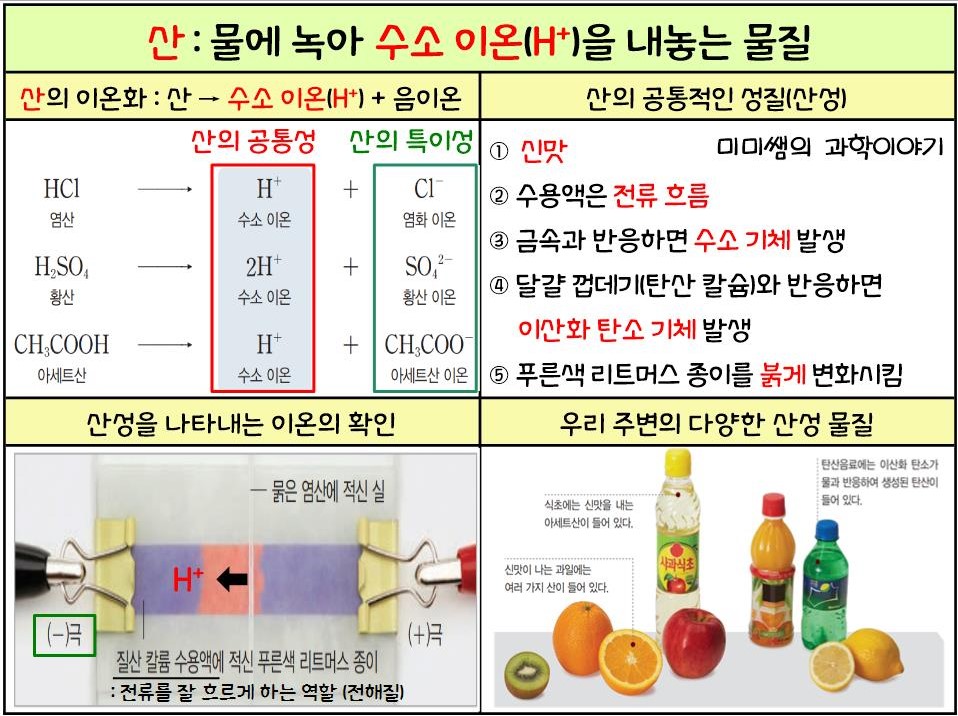
- 물에 녹고 수용액에서 수소이온(H+)을 방출하는 물질 → 산은 수소 이온(H+)에 의해 형성됩니다.
- 예) 염산(HCl), 황산(H2SO4), 초산(CH3COOH), 탄산(H2CO3) 등
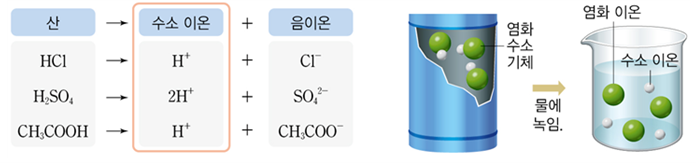
- 산 이온화: 산은 물에 용해되어 수소 이온(H+)과 음이온으로 이온화됩니다.
- 다른 산은 다른 음이온으로 인해 다른 특성을 갖습니다.

베이스
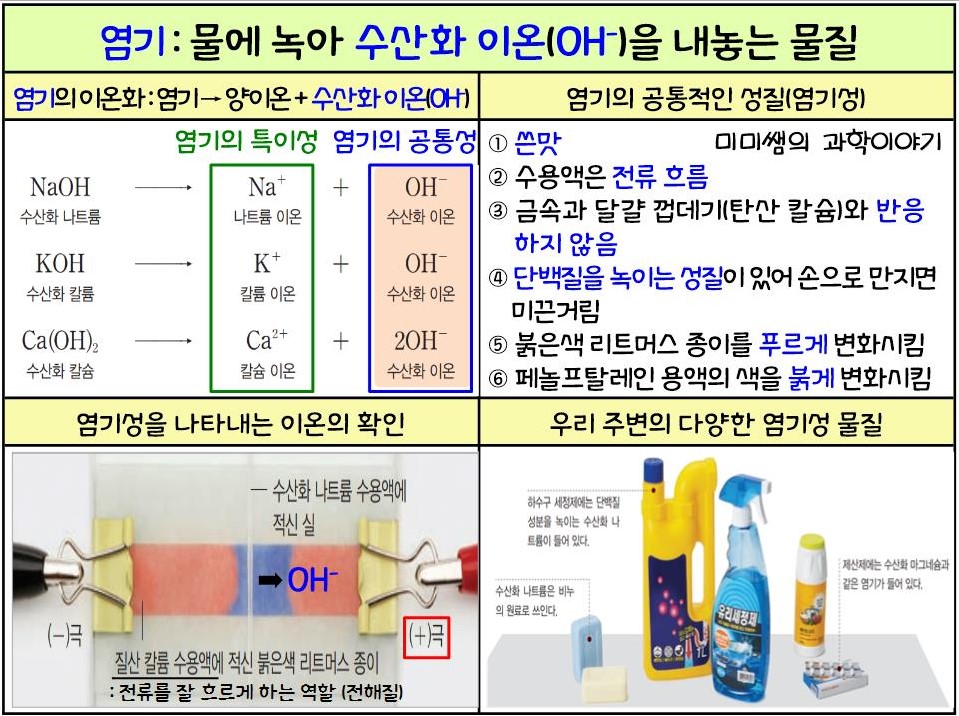
- 물에 녹았을 때 수산화물 이온(OH-)을 방출하는 물질 수산화물 이온(OH-)에 의한 염기성
- 예) 수산화나트륨(NaOH), 수산화칼륨(KOH), 수산화칼슘(Ca(OH)2), 암모니아수(NH4OH) 등
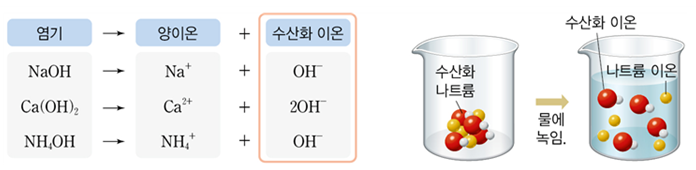
- 염기의 이온화: 염기는 물에 용해되어 양이온과 수산화물 이온(OH-)으로 이온화됩니다.

산과 염기의 일반적인 성질
산의 일반적인 특성(산도)
- 신맛, 수용액 스트림 흐름
- 아연 및 마그네슘과 같은 금속과 반응하여 수소 가스를 형성합니다.
-Zn + 2CHI → ZnCl2 + H&sub2; ↑
- 달걀 껍질(탄산칼슘)과 반응하여 이산화탄소 가스 방출
CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂ ↑
- 푸른 리트머스 종이가 붉게 변한다
거점 공동소유(기본성)
- 쓴 맛, 시냇물 흐름
- 금속이나 달걀 껍질(탄산칼슘)과 반응하지 않음
- 단백질을 녹이는 성질이 있어 손으로 만졌을 때 미끄러운 느낌이 든다.
- 붉은색 리트머스 종이는 파란색으로, 페놀프탈레인 용액은 빨간색으로


이온의 이동
전류가 가해지면 이온은 반대 전하를 띤 전극으로 이동합니다. 따라서 H+ 및 OH-뿐만 아니라 산의 음이온, 염기의 양이온, 질산칼륨의 K+ 및 NO3-도 반대 전하를 띤 전극으로 이동합니다. 그러나 H+와 OH-를 제외한 나머지 이온은 리트머스 종이의 색을 바꾸지 않기 때문에 육안으로는 나머지 이온의 움직임을 관찰할 수 없다.
산과 염기를 구별하는 방법
(1) 광고
⑴ 액체 및 수용액 지시약
- 수용액의 액체 : 산성, 중성 및 염기성으로 나뉩니다.
- 지시약 : 산에서는 수소이온(H+), 염기에서는 수산이온(OH-)과 반응하여 색이 변하는 물질.
➜ 용액의 액체에 따라 색이 변하는 물질.
- 수용액의 액체에 따른 지시약의 색상 변화

+ 자연 지표 : 수국꽃, 적양배추, 붉은장미꽃, 포도껍질, 검은콩 등에서 추출한 용액
(2) 산도
① pH 값: 수용액에 수소이온(H+)이 몇 개인지를 나타내는 값이다. ➜ pH값이 낮을수록 산성, 높을수록 염기성
